Aprobación de ética
Este estudio cumple con todas las regulaciones éticas relevantes para la investigación que involucra a los participantes humanos y se realizó de acuerdo con los criterios establecidos por la Declaración de Helsinki. El estudio de UKBB fue aprobado por el Comité Nacional de Ética de Investigación (17 de junio de 2011 (referencia de res11 /NW/0382) y se extendió el 10 de mayo de 2016 (referencia de res16 /NW/0274)). La recopilación, almacenamiento y análisis de bioespecímenes, datos genéticos y datos derivados de registros de salud electrónicos como parte del estudio PMBB está aprobado por el Protocolo IRB de la Universidad de Pensilvania #813913. Los participantes de las cohortes UKBB y PMBB proporcionaron consentimiento informado por escrito que permitía el uso de sus muestras y datos para fines de investigación médica. El uso de datos desidentificados de estos biobancos para esta investigación específica fue cubierto por las aprobaciones existentes. Todos los datos se manejaron de acuerdo con las regulaciones relevantes de protección de datos y privacidad. No se requirió una aprobación ética adicional para este análisis específico de los conjuntos de datos aprobados existentes. Este estudio se adhirió a los requisitos del fortalecimiento de la declaración de informes de estudios de observación en epidemiología (estroboscópico).
Población de estudio
El UKBB es un gran estudio de cohorte observacional prospectivo que reclutó a más de 500,000 adultos de 22 centros en todo el Reino Unido entre 2006 y 2010. Los participantes de 40 a 69 años se inscribieron y se han seguido para eventos de salud posteriores. El UKBB recopiló extensos datos de referencia, que incluyen datos demográficos, factores de estilo de vida y mediciones físicas, junto con muestras biológicas para el genotipado y el análisis de biomarcadores. Para el presente estudio, incluimos mujeres de ascendencia europea que tenían al menos un nacimiento vivo y datos genéticos disponibles. El protocolo completo del estudio UKBB está disponible públicamente para referencia.33.
El estudio PMBB (es decir, un biobanco médico académico a gran escala) reclutó no selectivamente participantes de entornos ambulatorios. Estos participantes proporcionaron acceso a sus datos de registros de salud electrónicos y generaron datos genómicos y biomarcadores34. Todas las clasificaciones internacionales de enfermedades (ICD) -9 e Códigos de diagnóstico ICD-10, imágenes clínicas y mediciones de laboratorio hasta julio de 2020 se extrajeron de los registros electrónicos de salud. Los flujos de trabajo subyacentes a este estudio se ilustran en las Figs suplementarias. 1 y 2.
Trastornos hipertensivos del embarazo y las comorbilidades
En el estudio de UKBB, las participantes femeninas proporcionaron detalles sobre su historial reproductivo, incluida la paridad, durante una encuesta de referencia. El HDP se definió como hipertensión gestacional, preeclampsia, eclampsia o preeclampsia superpuesta. Esta identificación se basó en autoinformes en la inscripción o en los códigos ICD correspondientes obtenidos de la atención primaria o los registros hospitalarios (Tabla complementaria 14). Del mismo modo, en el estudio PMBB, el HDP se definió utilizando códigos ICD relevantes.
Para evaluar el riesgo de HDP de acuerdo con el HDP-PRS, la edad en el primer embarazo y la presencia de una enfermedad que confieren un alto riesgo de HDP antes del embarazo se seleccionaron como covariables, de acuerdo con las pautas clínicas para los factores de alto riesgo para el HDP35,36. Según estas pautas, las altas enfermedades del riesgo de HDP incluyen hipertensión, diabetes mellitus y dislipidemia. La presencia de una enfermedad de HDP de alto riesgo antes del embarazo se determinó mediante autoinforme o diagnóstico con códigos ICD relevantes para cada enfermedad (Tabla complementaria 15) que ocurrió antes del primer nacimiento vivo.
Resultados cardiovasculares
Para analizar el ASCVD incidente y su asociación con HDP-PRS, los participantes con enfermedad cardíaca congénita fueron excluidos para eliminar la posible asociación entre la enfermedad cardíaca congénita y los resultados de CV (Métodos complementarios contiene los códigos de diagnóstico relevantes). Las comorbilidades metabólicas prevalentes, incluidas la hipertensión, la diabetes mellitus y la dislipidemia, se utilizaron como covariables de ajuste y se determinaron ya sea por autoinformación en los códigos de la ICD, como se describe en Métodos complementarios.
El ASCVD incidente se definió como un diagnóstico de enfermedad de la arteria coronaria, infarto de miocardio, accidente cerebrovascular isquémico, enfermedad de la arteria periférica o aneurisma aórtico después de la inscripción de participantes sin ECV preexistente. Además, el infarto de miocardio se definió algorítmicamente utilizando los datos de UKBB. Para cada ASCVD de inicio nuevo considerado, los participantes con una enfermedad preexistente al inscripción fueron excluidos del análisis. Por ejemplo, los participantes con enfermedad coronaria preexistente en la inscripción fueron excluidos del análisis de la enfermedad coronaria de la arteria coronaria nueva, lo que aseguró que la enfermedad de la arteria coronaria recurrente no se considerara erróneamente como enfermedad de la arteria coronaria de nuevo.
Variables
Durante el proceso de inscripción en el Estudio de UKBB, los participantes proporcionaron información sobre sus características sociodemográficas, la salud/historial médico y los factores de estilo de vida/medio ambiente a través de un cuestionario táctil autoadministrado y entrevistas de referencia en persona.
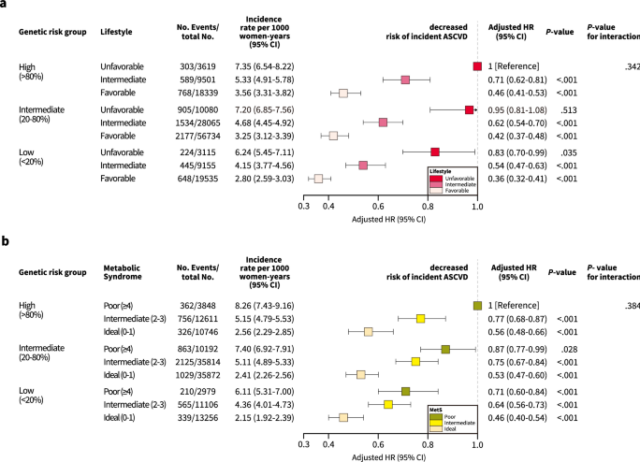
Según la AHA, cuatro factores definen principalmente comportamientos de estilo de vida; Estos incluyen el estado actual del tabaquismo, la obesidad, la actividad física y los hábitos alimenticios37,38. El estado de fumar se clasificó como fumador o no fumador actual. La obesidad se definió como un IMC ≥ 30 kg/m2 Según la Clasificación Internacional de la Organización Mundial de la Salud. Con respecto a la actividad física, los participantes fueron clasificados como que tenían un estilo de vida saludable si informaban más de cinco días por semana de actividad moderada o vigorosa. Los hábitos alimenticios se definieron siguiendo las recomendaciones sobre prioridades dietéticas para la salud de CV, que clasificaban los componentes dietéticos comunes como frutas, vegetales, granos integrales, pescado, lácteos, granos refinados, carnes procesadas y carnes sin procesar. Los hábitos alimenticios se consideraron saludables si los participantes se adhirieron a al menos la mitad de las recomendaciones dietéticas para la salud del CV, según lo evaluado utilizando un cuestionario de frecuencia alimentaria39. Colectivamente, los comportamientos de estilo de vida se clasificaron en tres grupos, no federables (0-1 factor de estilo de vida saludable)40intermedio (2 factores de estilo de vida saludables) y favorables (≥ 3 factores de estilo de vida saludables). Las descripciones y definiciones más detalladas de las variables consideradas en los comportamientos de estilo de vida se pueden encontrar en Métodos complementarios.
El estado de salud metabólica se identificó de acuerdo con la presencia de los cinco componentes de los MET en función de los criterios del informe de consenso de IDF41. El estado de salud metabólica se clasificó en tres grupos: ideal (factor METS 0–1), intermedio (2–3 factores de los Mets) y pobres (≥ 4 factores del Mets). Las descripciones detalladas y las definiciones de las variables consideradas en los MET se pueden encontrar en la Tabla complementaria 16 y Métodos complementarios.
En la cohorte PMBB, el estado de fumar y la obesidad (IMC ≥ 30) se utilizaron de manera restrictiva como variables para el análisis de replicación.
Genotipo de control de calidad de datos e imputación
Los procedimientos y la imputación de genotipado y control de calidad (QC) siguieron las prácticas estándar y se realizaron utilizando un par de plataforma de genotipado de cohorte. Se proporcionan más detalles en Métodos complementarios.
Biobanco del Reino Unido
Las muestras de UKBB (Versión 3; marzo de 2018) fueron genotipadas para más de 800,000 SNP utilizando la matriz de axiomas bilevos Affymetrix UK o la matriz de axiom de Affymetrix UKBB. Después de QC e imputación, se descubrió que 164,500 participantes europeas (británicas blancas) eran elegibles para los análisis genéticos de validación.
Penn Medicine Biobank
Los datos de PMBB consistieron en 43,623 muestras que fueron genotipadas utilizando una matriz de genotipado GSA. Después de la exclusión, 982 mujeres participantes parosas con ascendencia europea (blanca no hispana) y 1019 mujeres participantes parosas con ascendencia afroamericana (negra no hispana) se consideraron elegibles para el análisis de replicación.
Puntuación de riesgo poligénico
El HDP-PRS se generó utilizando estadísticas resumidas de un HDP GWAS a gran escala (13,071 casos y 177,808 controles) del consorcio de Finngen (congelación de datos R8V4)42. El PRS se calculó utilizando el método de predicción poligénica bayesiana PRS-CS43. Los PRS individuales se determinaron aplicando PLINK Versión 1.90 utilizando el comando –core y se calcularon a partir de coeficientes beta como la suma ponderada de los alelos de riesgo44. Los detalles del análisis PRS se describen en Métodos complementarios.
Análisis estadístico
Las características demográficas y clínicas se presentan como media ± DE o número (porcentaje). Las variables continuas se compararon con el estudiante T Prueba, ANOVA unidireccional o el Mann-Whitney U prueba, según corresponda. Las variables categóricas se compararon utilizando la prueba Chi-cuadrado o la prueba exacta de Fisher, según corresponda.
Para evaluar el riesgo de HDP de acuerdo con el HDP-PRS, utilizamos un modelo de regresión logística multivariante para evaluar la asociación entre HDP-PRS y HDP. Calculamos el OR y el IC del 95% después de ajustar la edad al primer nacimiento vivo, el IMC, el estado de fumar, las primeras diez PC de ascendencia y el tipo de matriz de genotipado en el modelo de regresión logística multivariante.
En el análisis primario, la asociación entre los resultados de CV HDP-PRS y el nuevo inicio se examinó utilizando el análisis de regresión de Cox multivariado. Se hicieron ajustes para una historia de HDP, edad en el primer nacimiento vivo, el IMC, el estado de fumar, las primeras diez PC de ascendencia y la matriz de genotipo para calcular la FC y el 95% de IC. Los OR y HR del PRSS para HDP se usaron como variables cuantitativas reportadas por SD, y las variables categóricas se definieron de la siguiente manera: Bajo (99%). Posteriormente, realizamos análisis de asociación conjunta para investigar la interacción entre el riesgo genético, el estilo de vida y el estado de los Mets. Además, realizamos análisis de sensibilidad basados en los subtipos de ASCVD.
Para el análisis de replicación, el impacto de mantener un estilo de vida favorable en diferentes grupos de riesgo genético se estudió utilizando la prueba de chi-cuadrado y el análisis de regresión de Cox en una cohorte de PMBB independiente. Entre las mujeres parosas de 2001 en la cohorte PMBB, los casos con ASCVD de inicio nuevo fueron pocas, pero el análisis condicional de regresión de Cox fue factible para la hipertensión incidente, considerando el estado de fumar y la obesidad (IMC ≥ 30) como variables de estilo de vida.
Todas las pruebas estadísticas fueron de dos lados, y la significación estadística se estableció en PAG44. Los detalles de los análisis estadísticos se describen en Métodos complementarios.
Resumen de informes
Hay más información sobre el diseño de la investigación disponible en el resumen de informes de la cartera de Nature vinculado a este artículo.